Rapamycin a diabetes: přítel, či nepřítel?
Rapamycin, zprvu považovaný za doplňkové léčivo, upoutal pozornost poté, kdy byl s úspěchem použit jako základní kámen imunosupresivního schématu při transplantaci Langerhansových ostrůvků. Řada center se následně snažila tento úspěch reprodukovat a vysvětlit. V centrech nově zahajujících program transplantací ostrůvků se pak rapamycin a zanedlouho jeho analog everolimus staly nejvíce používanými imunosupresivními léčivy. Inhibitory mTOR (mammalian target of rapamycin) se pak začaly více používat i při transplantaci pankreatu a vzbudily naději, že pomohou snížit výskyt nově vzniklého diabetu po transplantaci.
V tomto přehledu hodnotíme, do jaké míry se naplnila očekávání kladená na inhibitory mTOR v oblasti transplantace inzulin produkující tkáně a jaká je současná pozice inhibitorů mTOR v tomto specifickém transplantačním odvětví.
Úvod
Diabetes mellitus představuje závažné zdravotní riziko, jež se promítá prakticky do všech odvětví medicíny. Z více než 90 % postihuje dospělé a starší osoby a souvisí s porušenou účinností inzulinu v rámci metabolického syndromu, kdy B buňky pankreatu nestačí čelit rostoucí inzulinové rezistenci a selhávají (diabetes mellitus 2. typu). U dětí a mladých naopak vzniká častěji diabetes mellitus 1. typu, který je způsoben postupným zánikem B buněk pankreatu vlivem autoimunitní destrukce a je charakterizován absolutním nedostatkem inzulinu. Pro oba typy diabetu je společné, že jsou při dlouholetém trvání provázeny rozvojem pozdních orgánových komplikací, zejména diabetickou retinopatií, nefropatií, polyneuropatií a urychlenou aterosklerózou. Endogenní sekrece inzulinu může být úspěšně nahrazena orgánovou transplantací pankreatu nebo i transplantací izolovaných Langerhansových ostrůvků [1]. Se zlepšujícími se možnostmi chirurgické a imunosupresivní léčby je také čím dál více patrné, že riziko orgánových komplikací platí i pro pacienty s diabetem nově vzniklým po transplantaci orgánů či tkání. Moderní imunosupresivní léky na jedné straně zabraňují odhojení transplantovaného orgánu a jednoznačně zlepšují krátkodobé přežívání, ale na druhé straně mohou vyvolat či potencovat diabetickou poruchu a tím ohrožovat dlouhodobé výsledky. Výběr imunosupresiv je proto důležitý také z hlediska prevence potransplantačního diabetu a v případě transplantace tkáně produkující inzulin ještě z hlediska návratu diabetické poruchy.
Většina imunosupresivních protokolů zahrnuje v současné době látky, které vznik či progresi diabetické poruchy více či méně podněcují. Jedná se zejména o kortikosteroidy, které působí inzulinovou rezistenci. Vysoké dávky se používají zejména v indukčním období a při léčbě rejekce, zatímco v udržovacím období se zejména díky dostupnosti kalcineurinových inhibitorů jejich dávky rychle redukují, nebo je dokonce možné kortikosteroidy zcela eliminovat. Kalcineurinové inhibitory (CNI) na druhé straně blokují transkripci inzulinového genu [2] a narušují metabolismus B buněk pankreatu. Významnou redukci vzniku potransplantačního diabetu jejich zavedení tedy nepřineslo. Naději v tomto směru proto vzbudil objev rapamycinu, který má zcela odlišný mechanismus působení a také jiné spektrum nežádoucích účinků.
Metabolické efekty rapamycinu
Rapamycin byl objeven v 70. letech minulého století a byl pojmenován podle místa objevu na jednom z Velikonočních ostrovů – Rapa Nui. Rapamycin produkovaný aktinomycetou Streptomyces hygroscopicus, původně izolovaný pro antimykotické účinky, je nyní používán v transplantologii pro své imunosupresivní účinky. Jedná se o makrolidové imunosupresivum, které snižuje mRNA translaci a syntézu proteinů prostřednictvím útlumu mammalian target of rapamycin (mTOR). Tento nitrobuněčný receptor zpracovává signály pocházející z růstových faktorů, hormonů, živin, informace o množství buněčné energie a o úrovni stresu, které přicházejí jak z buňky samotné, tak z okolního prostředí. Je důležitý pro buněčný metabolismus, růst, proliferaci i indukci apoptózy. Inhibice mTOR vede k zastavení buněčného cyklu ve fázi G1. Chemicky nese podobné znaky jako takrolimus a oba se váží na stejný nitrobuněčný receptor FKBP-12.
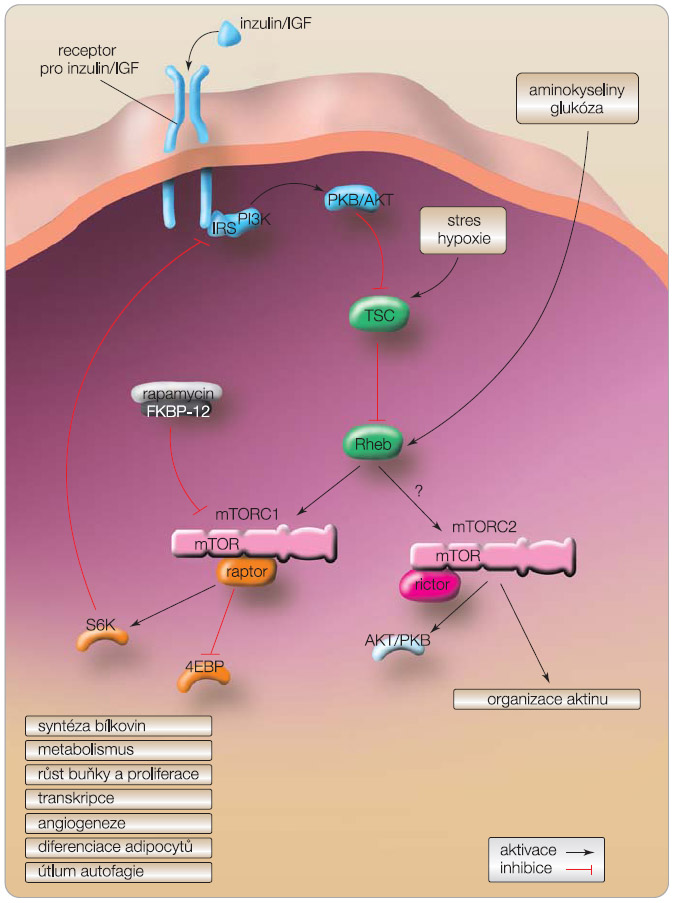 Mammalian target of rapamycin je částí dvou rozdílných multiproteinových komplexů, mTOR komplexu 1 (mTORC1) a mTOR komplexu 2 (mTORC2). V případě mTORC1 se rapamycin po navázání na FKBP-12 naváže na jeho specifickou podjednotku raptor, což následně vede k zastavení buněčného růstu. mTORC2 má podjednotku rictor, která je na rapamycin necitlivá a ovlivňuje organizaci aktinu a také nepřímo aktivuje mTORC1 prostřednictvím fosforylace proteinové kinázy B (PKB/AKT). mTORC1 reguluje translaci prostřednictvím ribozomální S6 kinázy (S6K) a inhibitoru translačního faktoru (4EBP). Inzulin a růstové faktory aktivují mTOR navázáním na inzulinový receptor, což vede k fosforylaci substrátů inzulinového receptoru (IRS-1, IRS-2). To vede dále k aktivaci fosfatidylinositol 3-kinázy (PI3K)-AKT dráhy. Aktivovaná proteinkináza B (PKB)/AKT vede k inaktivaci tuberous sclerosis complex (TSC); ten způsobuje inaktivaci malé GTPázy nazývané Ras homologue-enriched in brain (Rheb), která pak zůstává v inaktivované GDP vázané formě. Proto inaktivace TSC vede ke vzestupu GTP vázaného Rheb, a tím dochází k aktivaci mTOR [3], viz obr. 1.
Mammalian target of rapamycin je částí dvou rozdílných multiproteinových komplexů, mTOR komplexu 1 (mTORC1) a mTOR komplexu 2 (mTORC2). V případě mTORC1 se rapamycin po navázání na FKBP-12 naváže na jeho specifickou podjednotku raptor, což následně vede k zastavení buněčného růstu. mTORC2 má podjednotku rictor, která je na rapamycin necitlivá a ovlivňuje organizaci aktinu a také nepřímo aktivuje mTORC1 prostřednictvím fosforylace proteinové kinázy B (PKB/AKT). mTORC1 reguluje translaci prostřednictvím ribozomální S6 kinázy (S6K) a inhibitoru translačního faktoru (4EBP). Inzulin a růstové faktory aktivují mTOR navázáním na inzulinový receptor, což vede k fosforylaci substrátů inzulinového receptoru (IRS-1, IRS-2). To vede dále k aktivaci fosfatidylinositol 3-kinázy (PI3K)-AKT dráhy. Aktivovaná proteinkináza B (PKB)/AKT vede k inaktivaci tuberous sclerosis complex (TSC); ten způsobuje inaktivaci malé GTPázy nazývané Ras homologue-enriched in brain (Rheb), která pak zůstává v inaktivované GDP vázané formě. Proto inaktivace TSC vede ke vzestupu GTP vázaného Rheb, a tím dochází k aktivaci mTOR [3], viz obr. 1.
Transplantace Langerhansových ostrůvků a Edmontonský protokol
Před zveřejněním Edmontonského protokolu byla úspěšnost transplantace Langerhansových ostrůvků, hodnocená podle nezávislosti na exogenním inzulinu, nízká. Jen asi 8 % léčených osob nepotřebovalo po jednom roce od transplantace inzulinovou léčbu. Skutečný průlom nastal teprve v roce 2000, kdy Edmontonská skupina publikovala článek o úspěšných transplantacích Langerhansových ostrůvků při použití imunosupresivního protokolu s vyloučením kortikoidů [4]. Jako základ imunosupresivního schématu byl prvně použit rapamycin, dosud považovaný pouze za doplňkové léčivo, spolu s malou dávkou takrolimu. Dalším důležitým aspektem tohoto protokolu je aplikace dostatečného množství ostrůvků (více než 10 000 ostrůvkových ekvivalentů na kg hmotnosti příjemce), k čemuž je zpravidla nutné transplantaci jednou či dvakrát opakovat. V několika světových centrech se tak podařilo dosáhnout nezávislosti na zevním inzulinu po 1 roce od transplantace u 70 % pacientů, což se již blíží výsledkům orgánové transplantace pankreatu. Ta je ovšem provázena mnohem častějšími vedlejšími účinky, jež 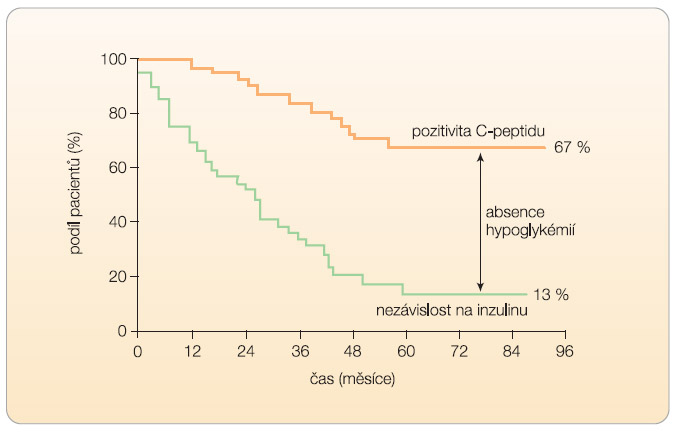 plynou ze složitého chirurgického zákroku. Při delším sledování se však ukazuje, že většina pacientů potřebuje později pro dobrou kompenzaci diabetu určitou dávku exogenního inzulinu a po 5 letech zůstává bez jeho potřeby pouze asi 13 % léčených osob [5]. Kumulativní výskyt nezávislosti na zevním inzulinu ukazuje graf 1. I když jen malá část pacientů zůstává po 5 letech bez potřeby inzulinu, klinicky významná produkce C-peptidu zůstala u většiny z nich. Zachovaná endogenní produkce inzulinu nejen přispěla k vynikající metabolické kompenzaci, ale zejména zabránila vzniku těžkých hypoglykemických stavů při syndromu porušeného vnímání hypoglykémie u pacientů léčených inzulinem, které byly hlavní indikací k tomuto způsobu léčby. Výsledky edmontonského pracoviště u pacientů po izolované transplantaci ostrůvků ukazují, že i když pouze 13 % pacientů zůstává po 84 měsících od transplantace nezávislých na inzulinu, 67 % z nich vykazuje přetrvávající sekreci C-peptidu spolu se snížením výskytu těžkých hypoglykemických příhod.
plynou ze složitého chirurgického zákroku. Při delším sledování se však ukazuje, že většina pacientů potřebuje později pro dobrou kompenzaci diabetu určitou dávku exogenního inzulinu a po 5 letech zůstává bez jeho potřeby pouze asi 13 % léčených osob [5]. Kumulativní výskyt nezávislosti na zevním inzulinu ukazuje graf 1. I když jen malá část pacientů zůstává po 5 letech bez potřeby inzulinu, klinicky významná produkce C-peptidu zůstala u většiny z nich. Zachovaná endogenní produkce inzulinu nejen přispěla k vynikající metabolické kompenzaci, ale zejména zabránila vzniku těžkých hypoglykemických stavů při syndromu porušeného vnímání hypoglykémie u pacientů léčených inzulinem, které byly hlavní indikací k tomuto způsobu léčby. Výsledky edmontonského pracoviště u pacientů po izolované transplantaci ostrůvků ukazují, že i když pouze 13 % pacientů zůstává po 84 měsících od transplantace nezávislých na inzulinu, 67 % z nich vykazuje přetrvávající sekreci C-peptidu spolu se snížením výskytu těžkých hypoglykemických příhod.
Vliv inhibice mTOR na glycidový metabolismus
Rapamycin byl zprvu považován za léčivo bez toxického účinku na B buňky pankreatu. Postupem času se však ukázalo, že dráha mTOR ovlivňuje i pochody spojené s inzulinovou senzitivitou, s přežíváním B buněk a se sekrecí inzulinu. Dráha mTOR/S6K je zásadní pro adaptaci B buněk na hyperglykémii. Proto zablokování této dráhy přítomností rapamycinu vede k dysfunkci B buněk a k jejich zániku. Rapamycin nepříznivě ovlivňuje preexistující metabolický syndrom a může být toxický pro endogenní nebo transplantované pankreatické ostrůvky v přítomnosti hyperglykémie.
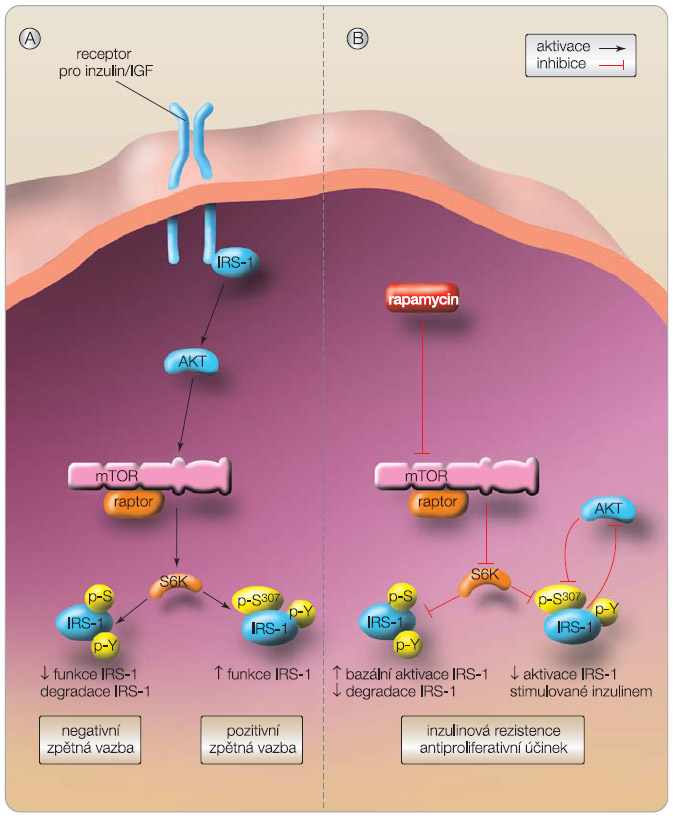 Mechanismus diabetogenního účinku je vysvětlován poklesem AKT fosforylace jak za bazálních, tak za inzulinem stimulovaných podmínek. AKT je primárně zodpovědný za mnoho metabolických účinků inzulinu. Proto není překvapující, že snížení aktivace AKT signifikantně koreluje se vzestupem inzulinové rezistence [6]. Rapamycin také vede k dysregulaci fosforylace tyrozinu IRS-1 a IRS-2 proteinů (viz obr. 2). Velmi podobné prvky se objevují u pacientů s diabetem 2. typu, stejně tak jako při poruše glukózové tolerance u přímých příbuzných pacientů s DM 2. typu. Léčba rapamycinem narušuje i diferenciaci adipocytů a snižuje adipogenezi. Nedostatek S6K v tukové tkáni a ve svalech vede ke vzestupu b-oxidace mastných kyselin v mitochondriích. Dochází k poklesu mitochondriální aktivity se snížením membránového potenciálu, spotřeby kyslíku a syntézy ATP. Ve svalech dochází k poklesu mitochondriální genové exprese a oxidativní fosforylace [7]. U pacientů po transplantaci ledviny, kterým byl pro nežádoucí účinky odebrán z kombinace kalcineurinový inhibitor a kteří poté dostávali pouze monoterapii rapamycinem, byl zjištěn signifikantní pokles inzulinové senzitivity a porucha odpovědi B buněk oproti hodnotám před změnou imunosuprese. Zdá se proto, že kombinovaná terapie s kalcineurinovými inhibitory má menší diabetogenní účinek než terapie samotným rapamycinem [8].
Mechanismus diabetogenního účinku je vysvětlován poklesem AKT fosforylace jak za bazálních, tak za inzulinem stimulovaných podmínek. AKT je primárně zodpovědný za mnoho metabolických účinků inzulinu. Proto není překvapující, že snížení aktivace AKT signifikantně koreluje se vzestupem inzulinové rezistence [6]. Rapamycin také vede k dysregulaci fosforylace tyrozinu IRS-1 a IRS-2 proteinů (viz obr. 2). Velmi podobné prvky se objevují u pacientů s diabetem 2. typu, stejně tak jako při poruše glukózové tolerance u přímých příbuzných pacientů s DM 2. typu. Léčba rapamycinem narušuje i diferenciaci adipocytů a snižuje adipogenezi. Nedostatek S6K v tukové tkáni a ve svalech vede ke vzestupu b-oxidace mastných kyselin v mitochondriích. Dochází k poklesu mitochondriální aktivity se snížením membránového potenciálu, spotřeby kyslíku a syntézy ATP. Ve svalech dochází k poklesu mitochondriální genové exprese a oxidativní fosforylace [7]. U pacientů po transplantaci ledviny, kterým byl pro nežádoucí účinky odebrán z kombinace kalcineurinový inhibitor a kteří poté dostávali pouze monoterapii rapamycinem, byl zjištěn signifikantní pokles inzulinové senzitivity a porucha odpovědi B buněk oproti hodnotám před změnou imunosuprese. Zdá se proto, že kombinovaná terapie s kalcineurinovými inhibitory má menší diabetogenní účinek než terapie samotným rapamycinem [8].
Vliv inhibice mTOR na regeneraci B buněk
Poslední publikovaná klinická aktualizace u pacientů s dlouhodobou funkcí ostrůvkových štěpů ukazuje, že funkce štěpu se v průběhu pětiletého období zhoršuje a vyžaduje aplikaci exogenního inzulinu k zachování těsné kontroly glykémií [5]. Toto snížení inzulinové produkce může nastat v důsledku zániku B buněk společně s jejich narušenou regenerací. Prekurzory pankreatických B buněk zůstávají neznámé. Na základě sledování buněčných linií in vivo u myší označili Dor a spolupracovníci [9] za zdroj novotvořených B buněk dospělé B buňky, které se za určitých okolností dělí. Jinak spíš ale převažuje domněnka, že za zdroj novotvořených buněk slouží některé pankreatické duktální či inzulární multipotentní progenitorové buňky, jež vlivem zevních stimulů proliferují a specificky se diferencují [10]. Duktální buňky obyčejně představují 20–30 % ostrůvkového štěpu. V každém případě se má za to, že fixní počet transplantovaných B buněk nemůže dlouhodobě postačovat a že k udržení dlouhodobé funkce je nutná endogenní obměna zprostředkovaná proliferačními signály.
Přidání rapamycinu ke kultivovaným lidským duktálním buňkám vede k poklesu množství buněk o 50 % v porovnání s kontrolní skupinou bez přidaného rapamycinu [11]. Na základě studia složení ostrůvkového štěpu bylo zjištěno, že pacienti, kteří obdrželi spolu s ostrůvky větší množství duktálních buněk, měli po 2 letech lepší akutní inzulinovou odpověď na podání glukózy. Celkové množství transplantovaných B buněk se přitom mezi sledovanými skupinami pacientů nelišilo [12]. Je proto možné, že větší příměs duktálních buněk v ostrůvkovém štěpu pomůže krátkodobě překlenout antiproliferativní účinek rapamycinu. Tento účinek, jedno zda na duktální buňky či na vlastní B buňky, může být jedním z důvodů postupného selhání ostrůvkového štěpu.
Vliv inhibice mTOR na vaskularizaci
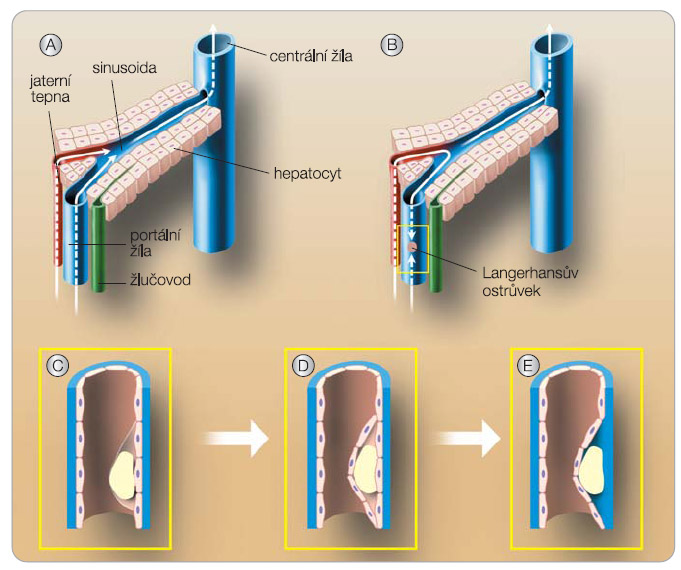 Rychlá revaskularizace ostrůvků embolizovaných do jater má pro jejich přežití zásadní význam. Ostrůvky jsou v játrech zachyceny ve větvích portální žíly, kde vlivem snížení hydrostatického tlaku za překážkou dochází k obrácení toku a k ostrůvkům se dostává i arteriální krev. Ostrůvky jsou tedy zásobeny jak žilní, tak arteriální krví [13]. Postupem času jsou ostrůvky zavzaty do cévní stěny a dochází k prorůstání kapilár (obr. 3). I přes úspěšnou revaskularizaci neodpovídá nové krevní zásobení fyziologickému stavu, neboť ostrůvky jsou v pankreatu protkány hustou sítí fenestrovaných kapilár a krevní tok směřuje od centra do periferie. Po transplantaci ale dochází k prorůstání nových kapilár od periferie a fenestrace chybí. Vaskulární endoteliální růstový faktor (VEGF), jak se ukázalo, je nejenom důležitý pro obnovu krevního zásobení, ale je produkován i samotnými ostrůvky. VEGF na podkladě autokrinního působení ovlivňuje jejich přežívání a atrahuje také jaterní endoteliální buňky příjemce, které postupně do ostrůvků prorůstají [14]. Rapamycin v závislosti na dávce signifikantně snižuje uvolňování VEGF ostrůvky, a to již od koncentrace 10 ng/ml. Snížená produkce VEGF B buňkami tak může porušit angiogenezi a přihojení ostrůvků.
Rychlá revaskularizace ostrůvků embolizovaných do jater má pro jejich přežití zásadní význam. Ostrůvky jsou v játrech zachyceny ve větvích portální žíly, kde vlivem snížení hydrostatického tlaku za překážkou dochází k obrácení toku a k ostrůvkům se dostává i arteriální krev. Ostrůvky jsou tedy zásobeny jak žilní, tak arteriální krví [13]. Postupem času jsou ostrůvky zavzaty do cévní stěny a dochází k prorůstání kapilár (obr. 3). I přes úspěšnou revaskularizaci neodpovídá nové krevní zásobení fyziologickému stavu, neboť ostrůvky jsou v pankreatu protkány hustou sítí fenestrovaných kapilár a krevní tok směřuje od centra do periferie. Po transplantaci ale dochází k prorůstání nových kapilár od periferie a fenestrace chybí. Vaskulární endoteliální růstový faktor (VEGF), jak se ukázalo, je nejenom důležitý pro obnovu krevního zásobení, ale je produkován i samotnými ostrůvky. VEGF na podkladě autokrinního působení ovlivňuje jejich přežívání a atrahuje také jaterní endoteliální buňky příjemce, které postupně do ostrůvků prorůstají [14]. Rapamycin v závislosti na dávce signifikantně snižuje uvolňování VEGF ostrůvky, a to již od koncentrace 10 ng/ml. Snížená produkce VEGF B buňkami tak může porušit angiogenezi a přihojení ostrůvků.
Inhibice mTOR a imunologická tolerance
Regulační T lymfocyty hrají klíčovou roli v kontrole autoimunitní odpovědi. Mezi několika mechanismy zahrnutými v periferní toleranci je za zásadní považována kontrola autoimunitní odpovědi navozená regulačními T lymfocyty. Dosud byly popsány nejrůznější podskupiny regulačních T lymfocytů (Tregs), mezi něž patří přirozeně se vyskytující CD4+ Tregs (nTregs), které jako jediné pocházejí přímo z thymu, a proto jsou přítomny v cirkulaci od narození. Představují cca 5–10 % z celkového množství CD4+ T buněk. nTregs udržují tolerancí tím, že tlumí nežádoucí imunitní odpověď na vlastní či cizí antigeny; nTregs jsou definovány na bázi vysoké exprese CD25, FOXP3, nízké nebo žádné exprese CD127 a neschopností produkovat interleukin 2.
Rapamycin evidentně podporuje zmnožení nTregs in vitro prostřednictvím útlumu proliferace efektorových T buněk a nezasahuje do novotvorby Treg buněk z naivních CD4+ T buněk. Oba tyto biologické efekty mohou podporovat navození tolerance in vivo. Podáváním samotného rapamycinu již před transplantací ostrůvků bylo možné zjistit jeho vliv in vivo na počet a funkci nTregs u pacientů s autoimunitním onemocněním. Bylo prokázáno, že léčba rapamycinem nemění počet, fenotyp, schopnost proliferace a schopnost produkce cytokinů cirkulujících nTregs. Nicméně schopnost suprese je u pacientů s DM 1. typu v průběhu léčby rapamycinem zlepšena v porovnání s těmi samými pacienty testovanými před léčbou. Přímý efekt rapamycinu na funkci lidských nTregs podporuje proto jeho klinické využití v imunosupresivních režimech cílených na navození tolerance. Na druhé straně, současné používání anti-CD25 monoklonálních protilátek (daklizumab, baziliximab) může tento pozitivní efekt narušit, neboť pacienti, kterým byla podána tato léčiva, mají masivní úbytek cirkulujících CD4+CD25+FOXP3+ T buněk v rozsahu měsíců po léčbě [15].
Protizánětlivý účinek inhibice mTOR
Ovlivnění produkce cytokinů a chemokinů v ostrůvkovém štěpu před transplantací a po transplantaci představuje důležitý směr při zlepšování výsledků transplantace. Zánik B buněk vyvolaný nespecifickým zánětem je způsoben indukcí apoptózy prostřednictvím cytokinů a chemokinů (zejména interleukin 1β, tumor nekrotizující faktor α spolu s interferonem gamma). Ty jsou produkovány nejen endokrinními, ale také neendokrinními buňkami, jako jsou duktální buňky a makrofágy. Přidání rapamycinu do kultivačního média k izolovaným Langerhansovým ostrůvkům množství makrofágů a prozánětlivých cytokinů a chemokinů snižuje. Zlepšuje se tak inzulinová sekrece a přežívání buněk in vitro. Studie provedené in vitro naznačují, že rapamycin přidaný v terapeutické koncentraci do kultury ostrůvků o čistotě 40–60 % (což odpovídá typické struktuře transplantované tkáně v klinických studiích), má výrazný protizánětlivý účinek [16]. Protizánětlivý účinek rapamycinu na ostrůvkový štěp tak částečně vysvětluje úspěšnost transplantací podle Edmontonského protokolu. V úvahu nyní připadá i přidání rapamycinu do předtransplantačního kultivačního média.
Závěr
Rapamycin a jeho analog everolimus představují potentní imunosupresiva, která mohou tvořit základ imunosupresivní léčby při transplantaci inzulin produkující tkáně a patří k nejvíce používaným imunosupresivním léčivům. Rapamycin je synergický s CNI a dovoluje jejich podávání v nízkých dávkách (takrolimus 2–5 ng/ml), a to bez kortikosteroidů. Rapamycin přispívá k navození imunologické tolerance a 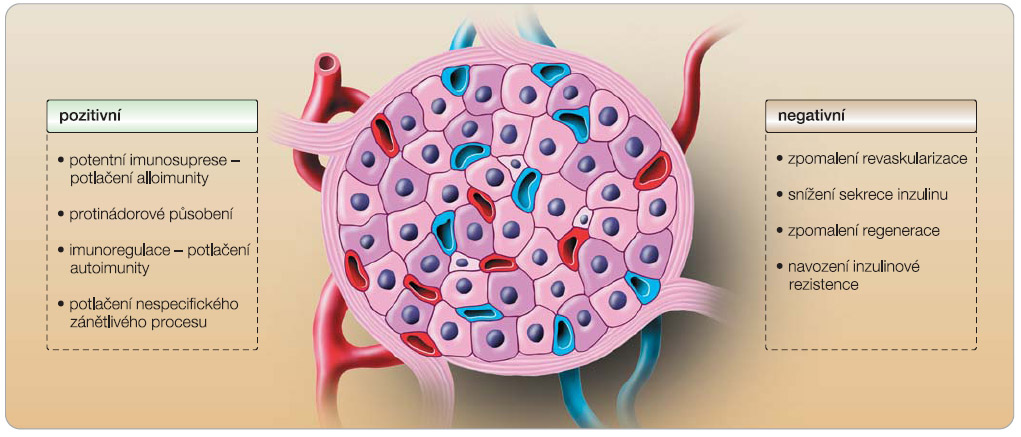 má protizánětlivé účinky, které brání nespecifickému poškození v místě implantace ostrůvků. V přítomnosti hyperglykémie rapamycin zhoršuje projevy metabolického syndromu, v závislosti na dávce snižuje sekreci inzulinu a zvyšuje nároky na jeho potřebu. Rapamycin zpomaluje revaskularizaci transplantovaných Langerhansových ostrůvků a podle nálezů in vivo snižuje endogenní regeneraci B buněk pankreatu. Účinky rapamycinu jsou přehledně shrnuty na obr. 4.
má protizánětlivé účinky, které brání nespecifickému poškození v místě implantace ostrůvků. V přítomnosti hyperglykémie rapamycin zhoršuje projevy metabolického syndromu, v závislosti na dávce snižuje sekreci inzulinu a zvyšuje nároky na jeho potřebu. Rapamycin zpomaluje revaskularizaci transplantovaných Langerhansových ostrůvků a podle nálezů in vivo snižuje endogenní regeneraci B buněk pankreatu. Účinky rapamycinu jsou přehledně shrnuty na obr. 4.
Ve srovnání s jinými potentními imunosupresivy (cyklosporin A, takrolimus, mykofenolát mofetil) má rapamycin malý kancerogenní potenciál a v některých případech kombinace založené na rapamycinu incidenci neoplastických onemocnění dokonce snižují. Z tohoto důvodu je podávání rapamycinu oprávněné zejména u osob, které nepodstupují transplantační léčbu z vitální indikace, jako jsou diabetičtí příjemci pankreatu či izolovaných Langerhansových ostrůvků. Oproti jiným dostupným imunosupresivním látkám mají inhibitory mTOR při transplantaci specifické výhody, ale do budoucna bude nutné optimalizovat jejich dávky i dobu podávání. V neposlední řadě bude třeba hledat látky nové, které nebudou interferovat s tvorbou a účinkem inzulinu a s endogenní regenerací B buněk pankreatu.
Tento článek vznikl za podpory grantu IGA NR/7917-6.
Seznam použité literatury
- [1] Saudek F. Léčba diabetu transplantací. Praha, Maxdorf, 2003.
- [2] Hernández-Fisac I, Pizarro-Delgado J, Calle C, et al. Tacrolimus-induced diabetes in rats courses with suppressed insulin gene expression in pancreatic islets. Am J Transplant 2007; 7: 2455–2462.
- [3] Wullschleger S, Loewith R, Hall MN. TOR Signaling in Growth and Metabolism. Cell 2006; 124: 471–484.
- [4] Shapiro AM, Lakey JR, Ryan EA. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med 2000; 343: 230–238.
- [5] Fiorina P, Shapiro AMJ, Ricordi C, et al. The Clinical Impact of Islet Transplantation. Am J Transplant 2008; 8: 1990–1997.
- [6] Di Paolo S, Teutonico A, Leogrande D, et al. Chronic Inhibition of Mammalian Target of Rapamycin Signaling Downregulates Insulin Receptor Substrates 1 and 2 and AKT Activation: A Crossroad between Cancer and Diabetes? J Am Soc Nephrol 2006; 17: 2236–2244.
- [7] Leibowitz G, Cerasi E, Ketzinel-Gilad M. The role of mTOR in the adaptation and failure of b-cells in type 2 diabetes. Diabetes Obes Metab 2008; 10 (Suppl. 4): 157–169.
- [8] Teutonico A, Schena PF, Di Paolo S. Glucose metabolism in renal transplant recipients: effect of calcineurin inhibitor withdrawal and conversion to sirolimus. J Am Soc Nephrol 2005; 16: 3128–3135.
- [9] Dor Y, Brown J, Martinez OI, et al. Adult pancreatic b-cells are formed by self-duplication rather than stem-cell differentiation. Nature 2004; 429: 41–46.
- [10] Bonner-Weir S, Sharma A. Pancreatic stem cells. J Pathol 2002; 197: 519–526.
- [11] Bussiere CT, Lakey JRT, Shapiro AMJ, et al. The impact of the mTOR inhibitor sirolimus on the proliferation and function of pancreatic islets and ductal cells. Diabetologia 2006; 49: 2341–2349.
- [12] Street CN, Lakey JRT, Shapiro AMJ, et al. Islet Graft Assesment in the Edmonton Protocol. Diabetes 2004; 53: 3107–3114.
- [13] Korsgren O, Lundgren T, Fellding M, et al. Optimising islet engraftment is critical for successful clinical islet transplantation. Diabetologia 2008; 51: 227–232.
- [14] Cross SE, Richards SK, Clark A, et al. Vascular endothelial growth factor as a survival factor for human islets: effect of immunosuppressive drugs. Diabetologia 2007; 50: 1423–1432.
- [15] Monti P, Scirpoli M, Maffi P, et al. Rapamycin Monotherapy in Patients With Type 1 Diabetes Modifies CD4+CD25+FOXP3+ Regulatory T-Cells. Diabetes 2008; 57: 2341–2347.
- [16] Mita A, Ricordi C, Miki A. Anti-Proinflammatory Effects of Sirolimus on Human Islet Preparations. Transplantation 2008; 86: 46–53.